Après l'Agence européenne du médicament (EMA), c'est au tour de la Haute Autorité de santé (HAS) ce mardi 20 septembre, d'autoriser les vaccins nouvelles générations contre le Covid-19 adaptés au variant Omicron. Une campagne de rappel couplée à la vaccination contre la grippe devrait commencer le 18 octobre prochain. Cette campagne s’effectuera alors qu’aucun essai clinique sur ces nouveaux vaccins ou sur l’administration concomitante des deux vaccins, n’ait été entrepris ou terminé.
La vaccination contre le Covid-19 couplée avec celle de la grippe
Dès l’automne, une partie des Français seront appelés à renouveler leur vaccination contre le Covid-19. Des vaccins nouvelles générations, plus adaptés au variant Omicron, vont être déployés sur le marché européen à l'automne 2022. Approuvés par l'Agence européenne des médicaments (EMA) et par la Haute Autorité de santé (HAS), ils sont fabriqués par les firmes Pfizer / BioNTech, pour deux d'entre eux, et par Moderna pour le troisième. Tous ciblent le variant Omicron et ses sous-lignages. Il s'agit de vaccins bivalents. Deux nouveaux vaccins, l'un de la biotech Moderna, l'autre de l'entreprise pharmaceutique Pfizer / BioNTech, contiennent tous deux la séquence ARN de la protéine Spike de la souche sauvage de Wuhan, à laquelle a été ajoutée la séquence ARN du variant BA.1. L'autre vaccin fabriqué par la firme Pfizer / BioNTech contient, lui aussi, la séquence ARN de la protéine Spike de la souche sauvage de Wuhan, à laquelle les chercheurs ont ajouté les séquences ARN de la protéine Spike des nouveaux sous-lignages BA.4 et BA.5.
Ces vaccins de rappel sont préconisés aux « personnes de plus de 60 ans ainsi que les adultes de moins de 60 ans à risque de forme grave de la maladie : ceux qui ont des comorbidités qui les exposent à ces formes sévères, les femmes enceintes, dès le 1ᵉʳ trimestre de leur grossesse, les personnes immunodéprimées quel que soit leur âge, les enfants et adolescents à haut risque souffrant de pathologies le justifiant », a écrit l’HAS dans son communiqué de presse qui recommande « indifféremment l'un des trois vaccins bivalents adaptés aux variants d’Omicron validés récemment par l’Agence européenne du médicament ».
Sont également concernés « l'entourage de ces personnes (stratégie de cocooning) ainsi que les personnes qui sont en contact régulier avec elles : professionnels du secteur sanitaire et médico-social ».
Par ailleurs, la HAS insiste pour coupler la vaccination contre le covid avec celle de la grippe, rappelant que « l’injection concomitante des deux vaccins est possible, si elle est réalisée sur deux sites d’injection distincts ».
Les doutes de la Haute Autorité de santé sur les nouveaux vaccins
« L’efficacité clinique attendue pour ces nouveaux vaccins bivalents est au moins équivalente, voire supérieure à celle des vaccins originaux monovalents, sans que cette probable supériorité puisse être actuellement démontrée en vie réelle », a écrit la HAS dans son communiqué.
À ces quelques lignes lourdes de sens, on comprend que la HAS n’a pas ou peu de données solides suffisantes quant à l’efficacité de ces nouveaux vaccins.
Faut-il encore rappeler que les vaccins monovalents ont été élaborés à partir de la souche sauvage de Wuhan disparue depuis plus de deux ans, qu’ils sont considérés comme obsolètes et que de nombreux scientifiques ont observé le phénomène ADE (Antibody Dependent Enhancement traduit en français par "facilitation par les anticorps") qui peut « survenir ultérieurement et se produire lorsqu’une personne est infectée par un autre sérotype viral pour lequel le phénomène ADE de facilitation par les anticorps existe, ce qui va favoriser l’infection ». Ce phénomène, qui a commencé avec l’apparition du variant Delta et qui s’est amplifié avec le variant Omicron et ses sous-lignages, peut difficilement être remis en question, alors que des milliers de personnes vaccinées ont contracté le virus et que certaines données officielles, comme celles qui sont régulièrement publiées au Royaume-Uni, montrent que les vaccinés sont au moins aussi exposés que les non vaccinés à des formes graves.
Par ailleurs, Israël, pionnier de la vaccination anti-Covid, n'a pas de meilleures données à afficher, comme le montre le tableau récemment publié ci-dessous.
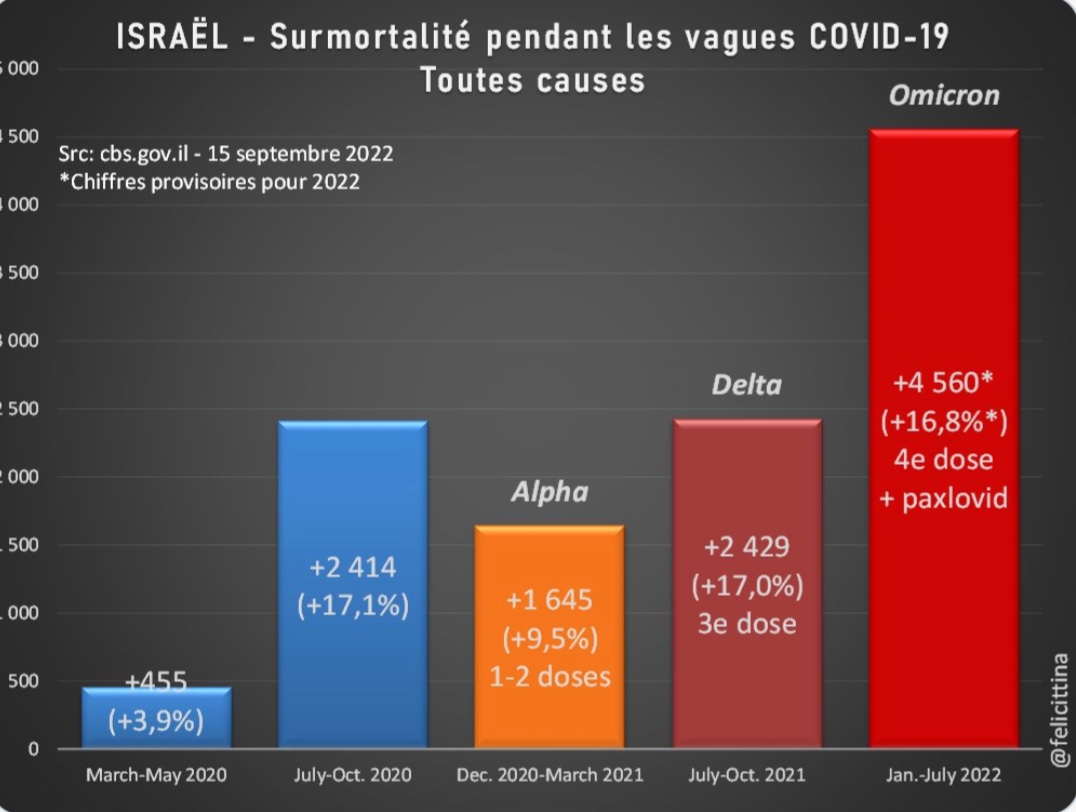
« Quant à leur tolérance, qui a été étudiée, elle est identique à celle des vaccins monovalents. C’est pourquoi, dans la cadre de la dose additionnelle recommandée cet automne, la HAS recommande d'utiliser, de préférence, un vaccin à ARNm bivalent, quels que soient les vaccins utilisés précédemment », déclare également la HAS.
La déclaration sur la tolérance est également problématique et ceci pour plusieurs raisons. D’abord, depuis la déclassification des documents de la FDA, on voit qu’il existe beaucoup de soupçons d’effets indésirables sur ces vaccins monovalents depuis le début de la campagne de vaccination. Les pharmacovigilances américaines et européennes ont enregistré un nombre de cas importants de décès et d’effets secondaires. Et, si l’imputabilité de la preuve n'est pas encore établie pour tous les cas, les très nombreux soupçons qui existent auraient peut-être dû amener les autorités à se poser un certain nombre de questions et peut-être à interrompre une campagne de vaccination le temps d’effectuer certaines vérifications comme cela avait été le cas pour la grippe porcine aux États-Unis en 1976, lorsque le programme de vaccination de masse avait été annulé deux mois plus tard après le signalement de 450 cas de syndromes de Guillain-Barré et 25 décès.
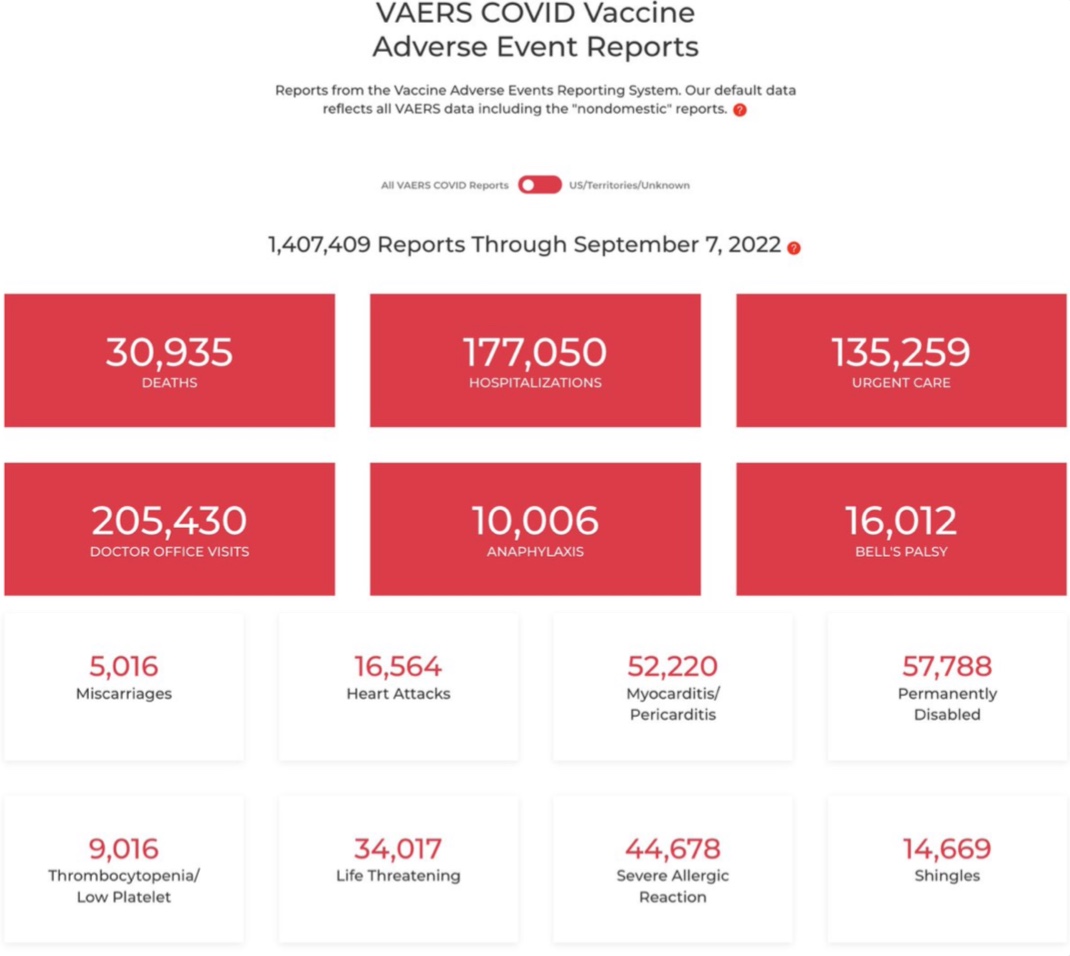
Par ailleurs, on est en droit de se demander comment la HAS peut parler d’une tolérance à l’identique, alors même que la vaccination en population générale n’a pas commencé et que ces vaccins n’ont pas (à l’exception d’un petit dosage des anticorps) fait l’objet d’études cliniques.
Une vaccination en population générale sans essai clinique terminé ou même commencé
Les trois vaccins ont réussi à obtenir une approbation de l’EMA et de la HAS sans qu'aucun essai thérapeutique n'ait démontré que le traitement était suffisamment actif et non toxique pour obtenir une autorisation d'utilisation, même en urgence.
La question qui demeure à propos de ces approbations est de savoir comment l’EMA et la HAS ont-elles pu réussir à évaluer ces trois candidats vaccins en l'absence d'études cliniques effectuées selon les bonnes pratiques cliniques ?
Vérifier l'efficacité, la tolérance et l'innocuité d'un nouveau traitement ou d'un nouveau vaccin demande un minimum de recul puisque les personnes qui ont participé à l'essai doivent faire l'objet d'un suivi pendant plusieurs mois, voire plusieurs années avant de proposer des nouveaux produits thérapeutiques en population générale.
Or, comme l'explique Jean-Jacques Devic, dans le cadre des deux nouveaux candidats vaccins bivalents ciblant le BA.1 : « Quelques fabricants sont en train de "tester", ou ont déjà testé cliniquement la réponse immunogène humorale des vaccins modifiés contenant Wuhan + Omicron BA.1 ». Ces études effectuées rapidement ont été réalisées pour contrôler essentiellement le niveau d'anticorps et « ne peuvent pas être démonstratives ni garantes d'une sécurité d'emploi pour tout nouveau variant », alors même que « cette souche BA.1, disparue depuis février 2022, est relativement éloignée au niveau phylogenèse de BA.4 et 5 ». Par conséquent, ces études ont essentiellement servi au Comité d'évaluation des vaccins de la FDA Vaccines and Related Biological Products Advisory (VRBPAC), le 28 juin dernier, pour faire « accepter » par l'agence américaine le vaccin génique bivalent (souche sauvage de Wuhan + souche Omicron BA.1).
Par ailleurs, comme on peut le vérifier en allant sur le site clinicaltrials.gov, deux études thérapeutiques sur ces nouveaux vaccins ont été mis en ligne. Les deux études concernent les thérapies géniques ciblant le variant BA.1. L'examen du document de Pfizer / BioNTech montre que l'étude n'aurait pas commencé puisqu'il est indiqué que la firme « cherche de nouveaux participants âgés de 18 à 55 ans, en bonne santé (qui peuvent avoir une maladie préexistante si elle est stable) ». Quant à celui de Moderna, il aurait démarré en juin 2022 avec une petite cohorte de 150 personnes. Randomisé et en double aveugle, les résultats définitifs ne seraient pas attendus avant le mois de juin 2023.
Aucun projet d'étude clinique n'a été trouvé pour le candidat vaccin de Pfizer / BioNTech destiné à cibler les sous-lignages BA.4 et BA.5.
La recommandation de la HAS de coupler le vaccin contre le Covid avec celui de la grippe soulève également des questions. Comme l’a écrit la biologiste Hélène Banoun dans un tweet, « cette association n’a pas été testée ».
L'administration de ces nouveaux vaccins va donc commencer en population générale sans qu'aucune information en matière d'efficacité sur le moyen et long terme, ou même de toxicité, ait fait l'objet d'une quelconque évaluation des résultats au regard des bonnes pratiques cliniques.

Aucun commentaire:
Enregistrer un commentaire
Remarque : Seul un membre de ce blog est autorisé à enregistrer un commentaire.