Effets du champignon Huaier sur la prévention et l'inhibition de la production spontanée de virions du SRAS-CoV-2 par la vaccination répétée à l'ARNm de Pfizer-BioNTech
Contexte : Les effets frappants de la stratégie de vaccination contre la pandémie de COVID-19, à travers les injections répétées d'ARNm, ont eu une influence inconnue à long terme. De plus, le mécanisme moléculaire dans le processus de vieillissement accéléré reste encore incertain. Grâce à notre recherche clinique, nous avons observé et rapporté la production spontanée de virions et de parties de virions du SRAS-CoV-2 après la vaccination par ARNm de Pfizer-BioNTech, observée à partir de 3 semaines après la première injection. Une destruction significative des structures d'ARN ribosomique, renforcée par des vaccinations répétées, a également été identifiée. La présente étude vise à définir les mécanismes moléculaires de la production de virions SARSCoV-2 après l'injection d'ARNm de vaccination avec une comparaison avec la prolifération des virions chez des patients non vaccinés atteints de pneumonie et de fibrose COVID-19 sévères.
Méthodes : Nous dirigeons la recherche clinique pour définir la base moléculaire de l'efficacité anticancéreuse significative du Huaier (Trametes robiniophila murr). Dans la présente étude, nous avons utilisé des échantillons de sang périphérique du patient volontaire, suspecté d'un cancer du poumon par analyse d'image CT avec des témoins normaux appariés selon l'âge avec ou sans administration de Huaier. La caractérisation moléculaire a été effectuée analysée par séquençage de l'ARN total et des petits ARN non codants sur la plate-forme BGISEQ-500 (environ 7,0 Go d'analyse par échantillon). Des événements génétiques approfondis, une analyse de Gene Ontology et une analyse de gène cible fonctionnel ont été effectués à l'aide de la classification des voies KEGGref) (https://www.genome.jp/kegg/).
Résultats : La production spontanée de virions du SRAS-CoV-2 a été identifiée après la vaccination par l'ARNm de Pfizer-BioNTech jusqu'à 5 mois après la 3ème dose. Nous avons comparé cette production de virions in vivo avec la prolifération de virus infectés à partir d'un cas de pneumonie COVID-19 sévère sans aucune vaccination, par séquençage d'ARN total. Aucun virion et particule de virion n'ont été détectés dans la normale c.
Mots clés
Huaier (Trametes Robiniophila Murr); contrôle de la transcription médicamenté par les miARN ; Voie de signalisation mTOR/PI3K/AKT ; Structure de l'ARN ribosomal ; Voie de signalisation COVID-19 ; SRAS-CoV-2
Détails de l'article
Inscription à l'essai
L'Association médicale japonaise (ID : JMA-IIA00335, la date d'enregistrement est le 1er février 2018).
1. Introduction
Dans le rapport précédent [1], notre recherche clinique a démontré la présence du virion du SRAS-CoV-2 et du virion en nombre, même 3 mois après la première vaccination, par classification Gene Ontology (GO) et analyse d'enrichissement fonctionnel des gènes exprimés de manière différentielle (DEG ). L'influence à long terme, sur 2 ans, de la vaccination répétée par ARNm contre le SRAS-CoV-2 n'a pas été clairement définie. Il convient de noter que, bien que les vaccins Pfizer-BioNTech et Moderna contiennent de l'ARNm qui code uniquement pour la protéine de pointe du SRAS-CoV-2 [2], des injections répétées de vaccins ont favorisé la production de nombreuses copies du SRAS-CoV-2. Les individus normaux peuvent généralement éliminer le matériel génétique étranger en quelques jours, mais la production de SARS-CoV-2 in vivo a été détectée à partir de 3 semaines après le 1ère vaccination, et a persisté même 5 mois après le 3ème vaccination. L'influence des ARNm auto-amplifiés injectés, en plus de la production spontanée ultérieure, reste incertaine. De plus, même avec plusieurs vaccinations, il y a encore suffisamment de possibilité d'infection au COVID-19 avec de nouvelles souches mutées [3]. Il y a une certaine limite à l'efficacité préventive des injections répétées de vaccination anti-SARS-CoV-2, et plus important encore, les problèmes des injections en série ont été soulevés concernant les effets destructeurs sur les mécanismes moléculaires de la synthèse des protéines en provoquant des structures destructrices d'ARN ribosomal [ 1, 4−7]. Cela a soulevé de nombreuses questions sur les mécanismes, à la fois dans les virions du SRAS-CoV-2 et dans les systèmes physiologiques des patients, pour induire la gravité de la pathogenèse par l'infection par le SRAS-CoV-2. Il n'en est pas moins important de souligner que les problèmes de la pneumonie sévère COVID-19 existent non seulement dans la maladie elle-même mais aussi dans les stratégies de traitement sévères et douloureuses et les complications de longue durée qui en découlent [2, 3]. Actuellement, nous nous lançons dans l'ère post-pandémique de la COVID-19 et avons constaté qu'il reste encore plus de problèmes à résoudre, tels que des stratégies préventives plus efficaces et/ou des complications après des traitements invasifs. Nous avons commencé l'analyse génomique et génétique de la vaccination par ARNm de nos patients atteints de cancer à partir d'avril 2020 [1, 8-15], et examiné toute altération de la stabilité génomique et des processus de traduction et de transcription ultérieurs [12]. Les résultats de nos recherches précédentes ont démontré qu'une flexibilité et une capacité génomiques étendues provenaient d'infections virales opportunistes, et que ce potentiel génomique est la base pour se remettre des maladies [12]. Huaïer (Trametes robiniophila murr), la phytothérapie naturelle sur les patients cancéreux (licence administrative chinoise n° Z-20000109) [8-15], contribue à rendre ce potentiel génomique efficace pour le sauvetage des réseaux de signalisation physiologiques perturbés. Nous avons constaté que Huaier pouvait compenser tout dommage causé par les structures destructrices de l'ARN ribosomique après la vaccination par l'ARNm contre le SRAS-CoV-2, en fonction du potentiel génomique de chaque individu, indépendamment de la gravité du cancer ou des conditions de santé de base [1]. Le processus de vieillissement accéléré [16] dans le métabolisme des lipides a également été observé, ce qui affecte la production de micro-emboles, provoquant un nombre croissant d'infarctus cérébraux et cardiaques dans la population japonaise. En outre, il n'est pas clair de distinguer les différences exactes dans l'influence sur les systèmes physiologiques entre les particules virales intrinsèques/spontanées par les vaccinations en série et le virus SARS-CoV-2 extrinsèque/infecté. La présente étude, ainsi que le rapport précédent [1], nous avons réussi à fournir un indice et une solution à ces problèmes, y compris une stratégie de prévention et de traitement sans aucune complication. Il est également indiqué que la réparation des structures destructrices de l'ARN ribosomal était un bon indicateur du risque de production spontanée de virions ainsi qu'un bon indicateur du processus de récupération. Les systèmes moléculaires affectés par ces améliorations étaient étroitement liés au processus de vieillissement, via l'activation des réseaux de signalisation liés à la kinase mTOR/PI3K/AKT [12] comme indiqué précédemment [1]. La nouvelle caractérisation d'analyse KEGG (panel COVID-19 No. hsp05171) a également démontré l'influence des virions du SRAS-CoV-2 et de la partie virion sur le métabolisme des lipides. Une petite dose de Huaier, 6 g par jour, suffit à prévenir l'infection par le SRAS-CoV-2 ainsi que tout dommage inattendu dans les systèmes moléculaires dans ce contrôle normal. Les effets Huaier ont contribué à contrôler la régulation de la fonction kinase via les réseaux de signalisation mTOR/PI3K/AKT, ont coopéré avec un contrôle transcriptionnel massif médicamenté par les mi- et pi-ARN [1, 8-15]. La présente étude fournit ainsi une stratégie efficace et non dangereuse pour faire face à l'ère COVID-19 postpandémique à venir. Les effets Huaier ont contribué à contrôler la régulation de la fonction kinase via les réseaux de signalisation mTOR/PI3K/AKT, ont coopéré avec un contrôle transcriptionnel massif médicamenté par les mi- et pi-ARN [1, 8-15]. La présente étude fournit ainsi une stratégie efficace et non dangereuse pour faire face à l'ère COVID-19 postpandémique à venir. Les effets Huaier ont contribué à contrôler la régulation de la fonction kinase via les réseaux de signalisation mTOR/PI3K/AKT, ont coopéré avec un contrôle transcriptionnel massif médicamenté par les mi- et pi-ARN [1, 8-15]. La présente étude fournit ainsi une stratégie efficace et non dangereuse pour faire face à l'ère COVID-19 postpandémique à venir.
2. Méthodes
2.1 Prélèvement d'échantillons et politique d'éthique médicale
Des échantillons de sang ont été prélevés sur un patient et deux étaient des volontaires sains comme témoins. La présente étude a été strictement menée selon les directives de la Déclaration d'Helsinki et les principes de bonne pratique clinique. Un consentement éclairé écrit a été obtenu des patients. Cette recherche clinique a été appliquée conformément aux directives des normes consolidées d'essais de recherche clinique et a été enregistrée auprès de l'Association médicale japonaise (ID : JMA-IIA00335, 1er février 2018). Le projet a été strictement mené avec un examen par le comité d'éthique composé d'experts en médecine, en soins infirmiers, en droit, en pharmacie et en affaires (premier comité tenu le 9 février 2018) [8-12, 14-17]. Huaïer (Les granulés Trametes robiniophila murr ) ont été préparés et fournis par le fabricant d'origine (licence administrative chinoise n° Z-20000109) et maintenus dans l'environnement souhaité jusqu'à leur utilisation (dans l'année suivant la production).
2.2 Contrôle de la qualité de l'échantillon d'ARN total
Un analyseur Agilent 2100 Bio (kit Agilent RNA 6000 Nano) a été utilisé pour effectuer le contrôle de la qualité de l'échantillon d'ARN total (CQ). L'élément QC) contient la concentration d'ARN, la valeur RIN, 28S/18S et la distribution de la longueur des fragments.
2.3 Bibliothèque et séquençage
Les échantillons de sang périphérique obtenus (neuf échantillons provenant d'un patient cancéreux et de deux témoins sains) ont été désignés pour un séquençage ultérieur. Tout d'abord, les molécules d'ARNm contenant du poly-A ont été purifiées à l'aide de billes magnétiques poly-T oligo-attachées. Après purification, l'ARNm a été fragmenté en petits morceaux en utilisant des cations divalents à température élevée. Après élimination de l'ARNr, l'ARN a été converti en ADNc en utilisant la transcriptase inverse et des amorces aléatoires. Cette étape a été suivie par la synthèse d'ADNc du second brin en utilisant l'ADN polymérase I et la RNase H. Ces fragments d'ADNc ont ensuite le processus d'addition par queue A et l'ADNc a été amplifié. Pour générer des bibliothèques, les produits amplifiés ont été séparés en ADN simple brin et cyclisés. Les bibliothèques RNA-seq ont été soumises à un séquençage avec l'option pair-end en utilisant le système BGISEQ-500 au Beijing Genomics Institute (BGI), Chine [15, 18]. Nous avons également effectué un séquençage total de petits ARN non codants sur la même plate-forme. Tout d'abord, des segments d'ARN de 18 à 30 nt ont été séparés par PAGE. La ligature des adaptateurs correspondants a été ajoutée aux extrémités 5 'et 3' de l'ARN, et les petits ARN ligaturés par l'adaptateur ont ensuite été transcrits en ADNc et le produit amplifié par plusieurs cycles. Ensuite, l'amorce RT a été étendue en sens inverse à l'étape suivante pour synthétiser l'ADNc brin, et la polymérase à ping élevé a été utilisée pour amplifier l'ADNc et enrichir l'ADNc avec des adaptateurs 3 'et 5'. L'ADN purifié a été utilisé pour la génération de clusters et l'analyse de séquençage à l'aide de la plate-forme BGISEQ-500. L'ARN total a été isolé des échantillons de sérum et regroupé pour construire des bibliothèques d'ADNc.
2.3 Traitement des données et analyse de l'expression ARN-seq
Les données de séquençage ont été analysées et filtrées à l'aide du logiciel soapnuke [19]. Les lectures propres ont été cartographiées sur le génome de référence humain GRCh38 avec le logiciel bowtie2. Ensuite, le niveau d'expression génique de chaque échantillon a été calculé à l'aide de RSEM [20]. Les gènes exprimés ont ensuite été analysés entre les groupes et ont été détectés par le logiciel DESeq2 [21]. Les gènes significativement exprimés différentiellement (DEG) ont été définis comme ceux avec un pli supérieur à 2 et une valeur p inférieure à 0,05.
2.4 Traitement des données et analyse de l'expression des miARN
Les données de séquençage de faible qualité ont été supprimées en premier, et les lectures ont été alignées sur la base de données miRbase avec le logiciel bowtie2 [22], et le niveau d'expression des miARN a été calculé et standardisé par TPM. Les miARN différentiellement exprimés entre deux échantillons ont été criblés strictement sur la base de la distribution de Poisson. Ensuite, nous avons effectué une correction de test d'hypothèses multiples pour la valeur p du test de différence, et pour juger de l'importance de la différence d'expression génique, FDR≤ 0,001, et la valeur absolue de Log2Ratio≥1 a été définie comme seuil par défaut. Les logiciels MiRanda [23] et TargetScan [24] ont été utilisés pour obtenir le gène cible des miARN exprimés de manière différentielle et pour extraire l'intersection ou l'union des gènes cibles comme résultat de prédiction final. Les voies métaboliques et de transduction du signal ainsi que leurs fonctions biologiques ont été déterminées. Des analyses d'enrichissement des voies et d'enrichissement de la signification GO ont été effectuées sur les gènes cibles des miARN ou des DEG exprimés de manière différentielle en utilisant le package R 'phyper'. Pour chaque valeur P, nous avons corrigé les comparaisons multiples en contrôlant le taux de fausse découverte. Les termes pour lesquels le FDR n'était pas supérieur à 0,01 ont été définis comme statistiquement significativement enrichis.
3. Résultats
3.1 Cours de temps d'échantillonnage et caractérisation des patients COVID-19
Sur des centaines d'échantillons analysés dans notre recherche clinique [1, 8-15], nous avons recruté 3 types de candidats volontaires pour la présente étude. Des échantillons de deux hommes japonais en bonne santé ont été utilisés comme témoins normaux avec (6 g par jour depuis novembre 2022) ou sans administration de Huaier. La caractérisation des données de séquençage de l'ARN total des deux a été rapportée et utilisée dans une série de nos rapports [1, 8-15]. L'autre était un patient atteint d'une pneumonie grave au COVID-19 traité avec Huaier à raison de 30 g par jour pendant 3 mois.
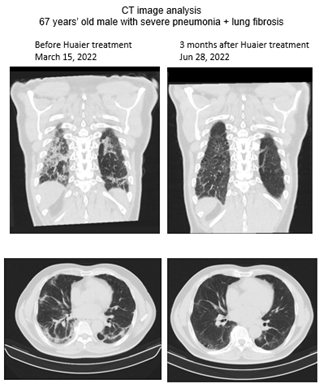
Figure 1 : Analyse de l'image du scanner thoracique avant (15 mars) et après 3 mois de traitement Huaier sur le patient (28 juin).
| Date du prélèvement sanguin |
15 mars 2022 |
30 mai 2022 |
|
||
| |
titre mesuré |
titre mesuré |
Valeurs standard |
||
| |
|
Haut ou bas |
|
Haut ou bas |
|
| IgG SAARS-CoV-2 |
pas testé |
|
6,83 |
|
<1.40 |
| KL-6 |
1 222 |
H |
610 |
H |
<500 |
| PCR |
0,82 |
H |
0,97 |
H |
<0,30 |
| GB |
10 090 |
H |
10 790 |
H |
3 500 ~ 9 700 |
| RBC |
476 |
|
508 |
|
436 ~ 577 |
| Hb |
13.4 |
|
14.3 |
|
13.6~18.3 |
| Ht |
43.1 |
|
46,7 |
|
40.4~51.9 |
| MCV |
91 |
|
92 |
|
83 ~ 101 |
| L'HME |
28.2 |
|
28.1 |
L |
28.2~34.7 |
| MCHC |
31.1 |
L |
30.6 |
L |
31.8~36.4 |
| Plt |
39,9 |
H |
38.3 |
H |
14.0~37.9 |
| Bas |
0,6 |
|
0,5 |
|
0.0~2.0 |
| Éosino |
4.8 |
|
3.3 |
|
0.0~7.0 |
| Neutre |
59,9 |
|
63,7 |
|
42.0~74.0 |
| Lympho |
28.3 |
|
27,6 |
|
18.0~50.0 |
| Protéines totales |
7.3 |
|
7.6 |
|
6.5~8.2 |
| Bilan total |
0,5 |
|
0,3 |
|
0.3~1.2 |
| ALP |
|
|
71 |
|
38 ~ 113 |
| LDH |
|
|
181 |
|
120~245 |
| AST (GOT) |
20 |
|
16 |
|
10 ~ 40 |
| ALT(GPT) |
18 |
|
13 |
|
5 ~ 45 |
| g-GTP |
26 |
|
20 |
|
<79 |
| PCK |
66 |
|
87 |
|
50 ~ 230 |
| Amylase |
79 |
|
73 |
|
39~134 |
| TG |
231 |
H |
222 |
H |
50 ~ 149 |
| HDL-C |
35 |
L |
33 |
L |
40 ~ 80 |
| C-LDL |
91 |
|
85 |
|
70 ~ 139 |
| ONU |
15 |
|
20 |
|
8.0~20.0 |
| Créatinine |
0,77 |
|
0,83 |
|
0,65 ~ 1,09 |
| UA |
8.2 |
|
7.1 |
H |
3.6~7.0 |
| N / A |
142 |
|
143 |
|
135~145 |
| K |
4.8 |
|
4.8 |
|
3.5~5.0 |
| CL |
105 |
|
106 |
|
98 ~ 108 |
| Glycémie |
116 |
H |
98 |
|
70 ~ 109 |
Tableau 1 : Comparaison des résultats des tests sanguins entre avant (15 mars) et après 3 mois de traitement Huaier sur le patient (28 juin).
3.2 Structures destructrices de l'ARN ribosomal identifiées chez le patient et le contrôle normal après la 3ème vaccination (sans administration de Huaier)
Ici, nous démontrons les résultats obtenus par le processus d'analyse en laboratoire, c'est-à-dire 1) à partir de l'extraction totale de l'ARN des échantillons de sang, 2) le contrôle de la qualité de l'ARN, 3) la construction de la bibliothèque d'ADNc et le séquençage total (y compris le séquençage de petits ARN non codants sur la même plate-forme), 4) le traitement des données et l'analyse de l'expression de l'ARN et des petits ARN nucléaires, et 5) l'analyse fonctionnelle des gènes cibles et des gènes différentiellement exprimés (DEG) et des petits ARN nucléaires différentiellement exprimés (DSG). Les ARN extraits ont été désignés pour quantifier la concentration d'ARN, les structures de ribosomes 28S/18S et 23S/16S et les valeurs du numéro d'intégrité de l'ARN (RIN) ou du numéro de qualité de l'ARN (RQN) pour la construction ultérieure de la bibliothèque. Figure 2, colonne de gauche dans chaque panneau, démontre les structures d'ARN ribosomique résultantes observées tout au long de la période de recherche dans la présente étude. Comme les échantillons de patients atteints d'un cancer très avancé 1, 8, les échantillons évalués comme risqués ou non qualifiés pour un traitement ultérieur sont indiqués par un astérisque (*) sur la figure 2, panneaux A et C). Étonnamment, une similitude remarquable dans le schéma destructeur a été observée entre le premier échantillon du patient (avant l'administration de Huaier ; Figure 2, panneau C) et celui du contrôle normal-1-3, 5 mois après le 3 ème vaccination (Figure 2, panneaux A et C ; indiqué par *). Le schéma destructeur identifié chez le patient a été amélioré et récupéré de manière significative au cours du temps de l'administration de Huaier, et est devenu dans les limites normales après 3 mois de traitement (Figure 2, panneau C, colonne de gauche). Le contrôle normal n° 2 (figure 2, panneau B) n'a montré aucun schéma destructeur. Il a eu une administration continue de Huaier à une faible dose de 6 g par jour à partir de novembre 2020. Sans administration de Huaier (contrôle normal n° 1 ; Figure 2, panneau A), une destruction progressive a été évidemment détectée, comme le pic 5S du côté haut , ce qui affecte l'imprécision quantitative et est propice à l'imprécision de la quantité de chargement et à la mauvaise qualité des données. Les valeurs RIN ou RQN étaient également légèrement inférieures à la norme,
Figure 2 : Structures ribosomales par analyse HPLC (colonne de gauche), avec réseau TF-DEG (colonne du milieu). Le moment de l'échantillonnage et les vaccinations Pfizer-BioNTech (panneau A. contrôle normal 1 ; panneau B. contrôle normal 2 ; panneau C pour les données du patient) sont indiqués sur le côté gauche de chaque panneau. Les points rouges et verts dans le réseau TF-DEG représentent respectivement les DEG régulés à la hausse et à la baisse. La boule violette représente un facteur de transcription, et plus le nœud est grand, plus le facteur de transcription régule de DEG. Dans la colonne de droite de chaque panneau, une comparaison du nombre de gènes différentiellement exprimés (DEG) a été placée en fonction de l'évolution temporelle de la vaccination Pfizer-BioNTech ; les barres rouges représentent les molécules régulées à la hausse et les barres bleues représentent les molécules régulées à la baisse.
3.3 Plasticité et flexibilité génomiques étendues démontrées par la vaccination répétée de l'ARNm Pfizer-BioNTech et au cours du premier mois de traitement Huaier
Un résumé des résultats de la séquence et des événements d'édition d'ARN est présenté dans le tableau supplémentaire étendu 1. Comme indiqué dans une série de publications de notre recherche clinique [1, 8-15], une plasticité et une flexibilité génomiques étendues ont été observées. Les détails de la caractérisation génétique et génomique de ces deux témoins normaux ont également été soulignés et mis en évidence dans le rapport précédent [1]. Cependant, le patient n'a pas démontré de différences significatives entre les événements de séquence par rapport à l'observation chez les patients cancéreux déjà rapportée [8-15]. Par exemple, nous avons identifié 135 700 types de variantes de SNP chez le patient infecté par le SRAS-CoV-2 dans l'analyse de l'échantillon en nombre moyen allant de 128 033 à 144 654 chez le patient, alors que 22 688 au total chez les individus sains normaux [18] sans Huaier ou ARNm vaccination (tableau étendu supplémentaire 1). L'augmentation significative du nombre total de SNP était cohérente avec les précieux rapports. L'infection virale ne semble pas affecter l'augmentation significative du nombre de SNP. Pour les variations SNP, les transitions A*G > C*T(I) étaient les mutations les plus courantes (301 899, 74,9 %), suivies des transversions C*G>G*T(I) (57 376, 14,2 %), et Transversions A*C>A*T (I) (43 563, 10,8 %), ce qui est cohérent avec les données obtenues parmi les patients cancéreux fournies dans les rapports précédents, et des témoins sains normaux avec des injections de vaccin à ARNm. À la suite de ces analyses, l'analyse du niveau d'expression génique nous a permis de comparer les niveaux de gènes différentiellement exprimés (DEG) entre les échantillons (données de traitement détaillées disponibles dans la base de données BGI ; voir la section Méthodes). Nous avons analysé les altérations quantitatives et qualitatives de tous les transcriptomes, DEG et DSG. Les résultats ont démontré ces relations DEG et l'analyse du réseau des facteurs de transcription codants (TF) a été effectuée [1, 8-15], et les résultats sont présentés dans la colonne du milieu des panneaux de la figure 2. Dans la colonne de droite, des changements quantitatifs dans la régulation à la hausse/à la baisse des DEG et des DSG (mi- et pi-ARN) ont été ajoutés dans chaque panneau (le nombre de gènes modifiés est écrit en haut de chaque barre). Aucune altération de l'ARNsi n'a été détectée dans la présente étude. Des changements drastiques de DEG ont été observés avec une démonstration de super-nova dans le réseau TF-DEG, qui étaient équivalents au niveau de quantité d'altération détecté chez les patients cancéreux [11-13] (Figure 2, panneau C). Comme noté précédemment [13], l'infection virale du patient évoque tout au plus des changements dans des altérations génétiques. Le nombre de DEG régulés à la hausse était de 2 577 au total à 3 mois, environ 10 % du nombre total de transcriptomes. De plus, plus d'effets inhibiteurs, la régulation à la baisse des transcriptomes ont été dépassés par rapport au nombre de ceux régulés à la hausse (Figure 2, panneau C). Les altérations des DEG étaient le résultat de presque toutes les régulations à la hausse, tandis que les altérations des DSG étaient régulées à la baisse. Les résultats des DEG et des DSG étaient controversés, ainsi que les résultats similaires obtenus en analysant des échantillons de patients atteints de cancer. De tels changements contradictoires entre les DEG et les DSG doivent être considérés comme un contrôle transcriptionnel médié par l'ARNs pour compenser l'influence physiologique du virion et des particules de virion, par rapport aux différents types de thérapie Huaier sur les patients cancéreux et les témoins normaux dans les rapports précédents [11-13] . Les résultats des modifications par réseau TF-DEG (Figure 2, panneaux B et C, colonne du milieu) a clairement démontré le style à la demande de compensation Huaier des systèmes physiologiques. Les altérations drastiques du DEG ont été évoquées en utilisant des facteurs transcriptionnels comme centres de réseau et ont cessé après une activité suffisante pour sauver les fonctions altérées. Il a été le plus souvent démontré au cours du premier mois de traitement Huaier du patient (régulation à la hausse) (Figure 2, panneau C), après le 3rdvaccination du contrôle normal 1 (régulation à la baisse) (Figure 2, panneau A) et à chaque période de contrôle normal 2 (presque aucune modification requise) (Figure 2, panneau B). Dans ces résultats, encore une fois, le style de régulation à la hausse et à la baisse était controversé entre les DEG et les DSG. Aucun facteur de transcription spécifique ou groupe de facteurs n'a été identifié dans la présente étude, ou tout au long de notre recherche clinique. Cependant, une régulation à la hausse massive des mi-ARN a été identifiée dans le contrôle normal 2, même si les altérations quantitatives du DEG étaient minimes (Figure 2, panneau B). Ici, nous avons une autre question; si le degré significativement bas du réseau TF-DEG change dans la figure 2, comment les dommages possibles causés par les structures destructrices de l'ARN ribosomal, qui pourraient affecter les processus de traduction et de transcription, peuvent-ils être restaurés et maintenus ? Bien sûr, on se souvient du potentiel génétique observé dans l'augmentation drastique des variants SNP/INDEL et de l'abondance totale des isoformes décrites ci-dessus. Nous devons identifier comment et pourquoi le réseau TF-DEG réduit au silence pourrait récupérer les dommages. Le rôle des DSG et de l'analyse qualitative des pi- et miARN est présenté dans le tableau 2.
Tableau 2 : Une liste de miARN et de piARN concernant le contrôle transcriptionnel sur les DEG identifiés dans les contrôles normaux 1-2 et le patient COVID-19 au cours de l'administration de Huaier. Les comparaisons de niveau DSG sont écrites par rapport Log 2. Les nombres réels de mi- et piARN régulés à la hausse/à la baisse sont indiqués dans tous les panneaux de la colonne de droite de la figure 2.
3.4 Analyse de la voie KEGG sur la cascade de signalisation COVID-19 (hsa05171) régulée par le réseau de signalisation intégré Kinase (cascades de signalisation mTOR/PI3K/AKT)
Ici, nous procédons à l'analyse fonctionnelle des gènes ciblés. Avec une analyse quantitative des DEG (Figure 2, colonne de droite de chaque panneau), nous avons effectué une classification de la voie KEGG (https://www.genome.jp/kegg/) pour définir le mécanisme détaillé sur les systèmes d'infection et de régulation du SRAS-CoV-2 [28]. Récemment, un autre panel KEGG de cascades de signalisation COVID-19 est devenu disponible (hsa05171). Le panneau A de la figure 3 résume l'analyse hsa05171 du patient avec une comparaison avec deux témoins normaux avec ou sans administration de Huaier. Les résultats ont révélé un changement étonnamment minimal dans les DEG, alors que les altérations brutes sont illustrées à la figure 2 (en haut de la colonne de droite dans chaque panneau). Des changements notables ont été identifiés dans l'expression de PI3K et les structures de la construction du ribosome 80S. L'étape suivante consistait à obtenir des informations détaillées sur le phosphatidylinositol-4, 5-bisphosphate 3-kinase (PI3K) et réseaux de signalisation de kinase intégrés associés. Nous avons démontré la cascade de signalisation mTOR/PI3K/AKT (carte de la voie KEGG04150) [28-34] dans le panneau B de la figure 3. Ici, nous montrons clairement la base moléculaire de la récupération ou du sauvetage de la fonction chez le patient. En revanche, l'échec de la compensation fonctionnelle a été typiquement démontré dans le contrôle normal 1 ; les transcrits étaient significativement régulés à la baisse et les gènes fonctionnels n'étaient pas activés, ce qui a également fourni une base moléculaire pour l'observation des changements destructeurs progressifs dans les structures de l'ARN ribosomal. Comme prévu, une augmentation essentielle minimale de la fonction kinase a été observée dans le contrôle normal 2, même si suffisamment d'altérations génétiques dans les facteurs de transcription ont été détectées. La voie de signalisation régulée par mTOR/PI3K/AKT kinase [16-17, 34-37], signalé comme responsable de la régulation de la synthèse de l'ARN ribosomique, a montré une relation significative avec les résultats démontrés en utilisant le panel KEGG hsa05171 (Figure 2 panel A). Avec ou sans administration de Huaier, la restauration et l'activation de la fonction PI3K et AKT kinase contribuent au maintien de réseaux de signalisation cellulaire normaux. Il a été rapporté que l'inhibition massive et la régulation à la baisse de facteurs apparentés dans la PI3K et la kinase AKT observées chez le témoin normal 1 entraînent un mauvais pronostic chez les patients cancéreux. Comme le montre la figure 3, l'activation du transfert de signal neuronal devrait être étroitement liée et nécessaire pour le maintien des mécanismes cellulaires. Ainsi, l'efficacité de l'administration de Huaier semblait être étroitement liée au sauvetage et à la réparation des fonctions endommagées après une infection par le SRAS-CoV-2.

Figure 3 : Analyse de la voie KEGG sur le panneau COVID-19 hsp05171 (panneau A) et la dérégulation transcriptionnelle et le panneau B de la voie de signalisation P13K/AKT). L'administration de Huaier a été appliquée chez le patient et le témoin normal n°2. (5 g/jour). Les barres rouges représentent les molécules régulées à la hausse et les barres bleues les molécules régulées à la baisse. Le chiffre a été choisi au moment de la plus grande flexibilité du réseau facteur de transcription-DEG chez chaque patient parmi les analyses en série sur une longue durée de traitement.
3.5 Analyse fonctionnelle GO sur les mécanismes cellulaires
Sur la base de l'annotation des voies DEG et KEGG [34], la figure 4 montre l'analyse de l'enrichissement de la voie et du processus, à la fois quantitativement et qualitativement, pour clarifier l'influence des particules de virion et de virion intrinsèques et extrinsèques. Diverses classifications des voies et informations fonctionnelles contribuant aux changements d'expression ont été démontrées. Dans la colonne du milieu du panneau A de la figure 4 (section des composants cellulaires), les nombres de virions et de particules de virions ont été notés. Comme on le voit clairement, la production de virions in vivoétait fortement similaire à celle du premier panel de patients (Figure 4, panneau B), indiquant une prolifération du virus extrinsèque/infecté. Fait intéressant, aucun virion n'a été détecté dans le contrôle normal 2 avec l'administration quotidienne de Huaier. Les résultats étaient cohérents avec les modèles d'ARN ribosomique destructeurs. Il semble que le nombre de virions était proportionnel à l'étendue de la destruction des ARN ribosomiques et diminué par le processus de récupération. Encore une fois, nous avons pu détecter des particules de virion produites par la vaccination par ARNm contre le SRAS-CoV-2 [1], qui est conçu pour ne produire qu'une partie du pic du virus. L'administration Huaier active les systèmes de réparation de la fonction cellulaire au total, mais comme indiqué dans le tableau supplémentaire étendu 2,

Figure 4 : L'analyse de la voie d'enrichissement GO de tous les DEG à 5 mois après la 3ème vaccination (contrôles normaux 1 et 2 dans le panneau A), et par l'évolution temporelle du traitement Huaier sur le patient (panneau B). L'axe X est les termes de la voie et l'axe Y est le nombre de gènes augmentés ou diminués. Les nombres de virion et de partie de virion étaient indiqués par * avec des nombres dans chaque voie. Les barres rouges représentent les molécules régulées à la hausse et les barres bleues représentent les molécules régulées à la baisse. Les flèches indiquent les changements quantitatifs dans les DEG régulés à la hausse (en couleur rouge) et régulés à la baisse (en couleur bleue).
3.6 Altérations quantitatives et qualitatives significatives des DSG (mi- et pi-ARN)
Dans la présente étude, de petits ARN non codants (ARNsnc) ont été séquencés simultanément à l'aide de la technologie BGISEQ-500 [12, 35]. Les statistiques des petits ARN non codants (DEG) et des miARN détectés sont présentées dans le panneau supérieur du tableau 2, et les piARN sont présentés dans le panneau inférieur tout au long de la période de recherche. Aucun siARN altéré n'a été identifié dans la présente étude. Les numéros détaillés de chaque échantillon sont déjà indiqués dans les panneaux de la figure 2. L'augmentation significative et drastique des DES régulés à la baisse (barres bleues) correspondait aux altérations significatives des facteurs transcriptionnels (total 2 216), comme indiqué précédemment. Cependant, de nombreux miARN répertoriés dans le tableau 2 n'avaient aucune relation fonctionnelle significative et significative avec la récupération de l'infection au COVID-19. Chaque individu a montré des modèles spécifiques de style d'altération DSG, et il convient de noter que les régulations à la hausse drastiques des DSG dans le contrôle normal 2 ont entraîné des modifications minimales des DEG [36]. La liste des altérations DEG est répertoriée dans le tableau 2. Les piARN avec le log le plus bas2 ratio ont été identifiés chez le patient dans le mois suivant l'administration de Huaier, c'est-à-dire, par ordre décroissant de nombre : 3 mois de traitement, 016735, 020496, 016658, 016659 et 020582 (020496, 016658 et 016659 ont été trouvés tout au long de la période de traitement).Cependant, ces séquences étaient encore fonctionnellement inconnues, sans relation possible avec l'un des TF codés. Nous n'avons pu que noter la relation controversée entre la régulation à la hausse et la régulation à la baisse dans les DEG et les DSG (en particulier dans les miARN).
4. Discussion
Ainsi, la thérapie adjuvante avec Huaier, régulateur de la fonction kinase [1], pour sauver les défauts causés par les structures destructrices de l'ARN ribosomal par une flexibilité et une capacité génomiques massives, ce qui pourrait être compatible avec la production de virions et de parties de virions du SRAS-CoV-2 in vivo. Comme représenté par la flexibilité excessive observée dans les SNP et les variantes de type épissage, nous avons fourni de nombreuses preuves que l'infection virale, y compris les infections opportunistes, pourrait provoquer tout au plus des modifications génomiques [13]. Ce ne sont pas des processus simples et la mobilité à l'échelle du génome semble avoir de l'importance pour les événements génétiques qui en résultent. La capacité moléculaire de la compensation fonctionnelle a été bien démontrée en tant que réseau TF-DEG (Figure 2, colonne du milieu), ce qui a par conséquent entraîné la récupération du processus de vieillissement accéléré dans le métabolisme des lipides [16, 38], la croissance des cheveux et la régénération des tissus [17 ], le transfert de signaux inter/intra neuronaux [17] et les systèmes de sécrétion endocrinienne [8-10]. Compte tenu de l'influence inhibitrice sur la gestion du DEG même avec le 3 èmeinjections de vaccins dans le contrôle normal 2, la consommation minimale d'énergie essentielle était suffisante pour cette compensation. La présente étude a révélé la production spontanée de virions après une vaccination répétée d'ARNm dans le contrôle normal 1 sans administration de Huaier (Figure 4 panneau A). Bien que Huaier n'empêche ni n'influence l'infection virale elle-même, l'efficacité de Huaier observée dans le contrôle normal 2 peut être spéculée pour contrôler les dommages latents de l'existence de particules virales par une régulation à la baisse de la production, et cela avec une petite dose de 6 g par jour. . L'ARN ribosomique est également la cible de nombreux antibiotiques cliniquement pertinents [37], cependant, l'influence de la vaccination par l'ARNm elle-même n'a pas encore été rapportée. Selon notre analyse séquentielle, nous devrions observer une influence à long terme des ARN ribosomiques de faible qualité après des vaccinations répétées d'ARNm par année. La présente étude, cependant, a fourni des preuves que la régulation à la hausse de la kinase AKT et son activation médiatrice de la voie de signalisation mTOR/PI3K/AKT sauvent ces dommages possibles [39-42]. La voie PI3K/AKT/mTOR est une voie de signalisation intracellulaire importante dans la régulation du cycle cellulaire. Par conséquent, il est directement lié à la quiescence cellulaire, à la prolifération, à la carcinogenèse et à la longévité. L'activation de TPI3K phosphoryle et active la kinase AKT [43]. L'AKT peut avoir un certain nombre d'effets en aval tels que l'activation de CREB [30], l'inhibition de p27 et p21 [44], pour un contrôle fonctionnel supplémentaire des cellules médié par un facteur de transcription et l'activation de la voie de signalisation mTOR [44]. Il existe de nombreux facteurs connus qui améliorent la voie PI3K/AKT, notamment l'EGF [45], le sonic hedgehog [30], l'IGF-1 [30], l'insuline [44] et la CaM [45]. La voie est antagonisée par divers facteurs dont PTEN [46], GSK3B [30] et HB9 [32]. Dans la présente étude, nous nous sommes concentrés sur l'importance de KL-6 en tant que biomarqueur dans la pneumonie et la fibrose COVID-19. KL-6, variante courte de la mucine S1, également appelée mucine épithéliale polymorphe (PEM) ou antigène de la membrane épithéliale (EMA), est une mucine codée par le MUC1 gène chez l'homme [38]. Les mucines tapissent la surface apicale des cellules épithéliales dans les poumons, l'estomac, les intestins, les yeux et plusieurs autres organes [25], qui remplissent une fonction protectrice en se liant aux agents pathogènes [26] et fonctionnent dans une capacité de signalisation cellulaire [27]. La surexpression et d'autres modifications de la protéine ont également été associées à la carcinogenèse. Les effets Huaier sur la réparation des tissus pulmonaires observés dans la présente étude ont également analysé les altérations DEG dans les 6 gènes qui seront responsables de la promotion de la croissance et de la prolifération plutôt que de la différenciation des cellules souches. Cependant, nous n'avons pas pu observer de relation significative (tableau étendu supplémentaire 2). On peut supposer que 1) Huaier pourrait compenser tout dommage causé par les structures destructrices de l'ARN ribosomal, mais en même temps, 2) l'ampleur de la compensation dépendait du potentiel génomique de chaque individu indépendamment de la gravité du cancer ou des conditions de santé de base, et/ou une régulation massive de toutes ces molécules responsables de la production de cellules iPS/ES était nécessaire. Les vaccins Pfizer-BioNTech et Moderna contiennent de l'ARNm qui code pour la protéine de pointe SARS-CoV-2. La présente étude a révélé que, lorsque les vaccins sont injectés, ils délivrent l'ARNm aux cellules, ce qui fait des copies non seulement du pic attendu, mais favorise également la production spontanée de virions. L'administration de Huaier a induit une régulation à la baisse significative de ces virions et des particules dérivées, qui ne dépendait pas de la dose de Huaier. Il a été rapporté qu'un vaccin auto-amplificateur sera introduit en plus de la stratégie vaccinale contre le SARS-CoV-2, et d'autres en développement incluent des enzymes d'alphavirus pour copier à plusieurs reprises le brin génétique à l'intérieur d'une cellule et rester dans le corps plus de deux fois plus longtemps. L'influence du vaccin à ARNm auto-amplifiant COVID-19 [47], ainsi que les copies spontanées de la production de virions restent incertaines, et nous avons besoin d'une réponse scientifique pour une nouvelle stratégie vaccinale pour surmonter cette influence à long terme de la vaccination (répétée) . Bien que nous puissions spéculer sur la relation possible entre la présence de production spontanée de virion SARS-CoV-2 et les structures destructrices d'ARN ribosomal, le rôle des particules de virion SARS-CoV-2 autoproductrices et son effet destructeur restent inconnus. Les résultats obtenus ici ont également montré que le contrôle normal 1 a décidé d'avoir l'administration de Huaier (20 g par jour) 3 semaines après la 4evaccination. Nous nous attendons à la récupération et à la modification de la structure endommagée de l'ARN ribosomique en observant une croissance massive des cheveux dans le mois suivant le traitement Huaier. Il n'y avait pas de miARN et de piARN spécifiques liés à la production de structure d'ARN ribosomique destructrice, alors que quelques rapports mentionnaient qu'un certain groupe de DSG était lié. Nous avons identifié des DSG massifs régulés à la baisse (tableau 2) qui ont été signalés précédemment comme étant des observations typiques, même chez des patients cancéreux, ainsi que des témoins sains normaux avec l'administration de Huaier. Il semble que ces effets n'étaient pas dépendants de la dose, contrairement à l'efficacité dose-dépendante du Huaier. Bien que les fonctions des piARN soient encore mal comprises, les piARN comme nouveaux outils d'attaque contre le COVID-19 sont signalés [48]. En revanche,
5. Conclusions
Par conséquent, la présente étude souligne à nouveau l'importance de la thérapie adjuvante Huaier sur toute stratégie contre le COVID-19, avec ou sans vaccination répétée, en tant que régulateur de kinase non dangereux. Ces résultats sont encourageants pour toute société humaine face à la prochaine ère post-pandémique de la COVID-19. Les données après les 4èmes vaccinations et le sauvetage de la structure d'ARN ribosomique perturbée dans le contrôle normal 1 par le traitement Huaier suivront.
Disponibilité des données
Les données de séquençage complètes des cas ont été déposées dans la base de données NCBI, et les résultats cliniques de ces cas ne sont pas accessibles au public pour la confidentialité des données, mais sont disponibles auprès du Dr Fei Teng : Sky.teng@bgi.com) et du Dr Manami Tanaka (e-mail : tubu0125@gmail.com, manami-tanaka@bradeion.com sur demande de collaboration de recherche. Le délai de réponse aux demandes d'accès aux données est de 30 jours. Il n'y a aucune restriction sur la réutilisation des données. De plus, les données brutes de la cohorte longitudinale et des individus sains analysés dans cette étude étaient disponibles chez GEO avec les identifiants du NCBI GEO (GSE157086).
Remerciements
Les auteurs tiennent à remercier les patients et les volontaires sains normaux qui ont aimablement collaboré à la présente étude.
Financement
La présente étude était une subvention de QiDong Gaitianli Medicines Co., Ltd. et Japan Kampo NewMedicine, Co., Ltd. La demande de fourniture de Huaier du monde entier doit être adressée à : Dr Zhengxin Lu, QiDong Gaitianli Medicines Co. Ltd., Province du Jiangsu, Chine. Courriel : lzx2777@163.com. ; lyh307@sina.com.
Contributions
T. et TT ont conçu l'étude à partir de l'observation clinique de patients atteints de cancer avec un traitement Huaier (en tant que thérapie complémentaire), géré l'échantillonnage et l'évaluation clinique des patients volontaires, analysé statistiquement les données et rédigé le manuscrit. FT, XZ et HLZL ont géré le séquençage de l'ARN total et du petit ARN nucléaire et effectué une analyse systématique des données. SS, TS et YM, ont contribué au diagnostic clinique et au traitement des patients, ainsi qu'à l'évaluation de la qualité de vie et des effets de l'administration de Huaier, ZL, DW, ont contribué à la fourniture de granules Huaier et à l'évaluation clinique des données, en particulier axé sur l'évaluation immunologique.
Approbation éthique et consentement à participer
Des échantillons de sang ont été prélevés sur un patient et deux étaient des volontaires sains comme témoins. La présente étude a été strictement menée selon les directives de la Déclaration d'Helsinki et les principes de bonne pratique clinique. Un consentement éclairé écrit a été obtenu des patients. Cette recherche clinique a été appliquée conformément aux directives des normes consolidées d'essais de recherche clinique et a été enregistrée auprès de l'Association médicale japonaise (ID : JMA-IIA00335, 1er février 2018). Le projet a été strictement mené avec un examen par le comité d'éthique composé d'experts en médecine, en soins infirmiers, en droit, en pharmacie et en affaires (premier comité tenu le 9 février 2018) [8-12, 14-15, 30-31] . Huaïer (Les granulés Trametes robiniophila murr ) ont été préparés et fournis par le fabricant d'origine (licence administrative chinoise n° Z-20000109) et maintenus dans l'environnement souhaité jusqu'à leur utilisation (dans l'année suivant la production).
Consentement à la publication
N'est pas applicable.
Intérêts concurrents
Les auteurs ne déclarent aucun intérêt concurrent.
Les références
- Tanaka M, Tanaka T, Zhu X, et al. Effets Huaier sur la compensation fonctionnelle avec la structure destructrice de l'ARN ribosomique après la vaccination par l'ARNm anti-SARS-CoV-2. Arch Clin Biomed Res 6 (2022): 553-574.
- Chakraborty S, Mallajosyula V, Tato CM, et al. Vaccins contre le SRAS-CoV-2 dans les essais cliniques avancés : où en sommes-nous ? Adv Drug Deliv Rev 72 (2021): 314–338.
- OMS, 2021. Rapport sur la situation du coronavirus (2021).
- Chan JC, Hannan KM, Riddell K, et al. AKT favorise la synthèse d'ARNr et coopère avec c-MYC pour stimuler la biogenèse des ribosomes dans le cancer". Sci Signal 4 (2011): ra56.
- Hoppe S, Bierhoff H, Cado I, et al. La protéine kinase activée par l'AMP adapte la synthèse d'ARNr à l'apport d'énergie cellulaire. Proc Natl Acad Sci USA 106 (2009): 17781-17786.
- Liang XH, Liu Q, Fournier MJ. La perte de modifications de l'ARNr dans le centre de décodage du ribosome altère la traduction et retarde fortement le traitement pré-ARNr. ARN 15 (2009) : 1716-1728.
- Brandman O, Hegde RS. Contrôle de la qualité des protéines associées aux ribosomes. Nat. Structure. Mol. Biol 23 (2016): 7-15.
- Tanaka M, Tanaka T, Teng F, et al. Huaier compense le transfert de signal altéré entre/intra neurones dans les systèmes nerveux central et périphérique. Arch Clin Biomed Res 5 (2021): 484-518.
- Tanaka M, Tanaka T, Teng F, et al. Huaier inhibe la progression du cancer et induit la régénération tissulaire par régulation transcriptionnelle de la pluripotence des cellules souches. J Altern Complement Integr Med 7 (2021): 162-172.
- Tanaka M, Tanaka T, Teng F, et al. Huaier inhibe la progression du cancer en corrélation avec l'EGFR muté et d'autres récepteurs tyrosine kinases (c-MET/erbB-2) par la régulation à la baisse de plusieurs voies de transduction du signal. Arch Clin Biomed Res 5 (2021): 262-284.
- Tanaka M, Tanaka T, Teng F, et al. Rémission complète du cancer de stade avancé sévère par le contrôle transcriptionnel médié par les miARN de Bcl-xL avec la thérapie Huaier par rapport à la chimiothérapie conventionnelle avec le complexe de platine (II). Arch Clin Biomed Res 5 (2021): 230-261.
- Tanaka M, Tanaka T, Teng F, et al. Effets anticancéreux de Huaier sur le cancer de la prostate ; Le contrôle de la transcription médié par les miARN a induit à la fois l'inhibition de la progression active et la prévention des rechutes. J Altern, Compl Integr Med 7 (2021): 146-154.
- Tanaka M, Tanaka T, Teng F, et al. Huaier induit la guérison du cancer en sauvant la fonction altérée du contrôle de la transcription en fonction du potentiel génomique individuel. Arch Clin Biomed Res 4 (2020): 817-855.
- Tanaka T, Suzuki T, Nakamura J, et al. Huaier régule le destin cellulaire en sauvegardant le contrôle de la transcription perturbé dans la voie de signalisation de l'hippopotame. Arch Clin Biomed Res 1 (2017): 179-199.
- Tanaka M, Tanaka T. Huaier Natural Herb Therapy for Cancer, Bradeion Institute of Medical Sciences Press (2022).
- Tanaka M, Tanaka T, Teng F, et al. Huaier inhibe la progression du cancer et induit la régénération tissulaire par régulation transcriptionnelle de la pluripotence des cellules souches. J Altern Complement Integr Med 7 (2021): 162-172.
- Tanaka M, Tanaka T, Zhu, X, et al. Croissance et restauration des cheveux par contrôle transcriptionnel de la régénération tissulaire dans le processus de guérison du cancer par Huaier. J Science du cancer et thérapeutique clinique 6 (2022): 288-315.
- Peng Z, Cheng Y, Tan BC, et al. Une analyse complète des données RNA-Seq révèle une édition étendue de l'ARN dans un transcriptome humain. Nat Biotechnol 30 (2012): 253-260.
- Chen Y, Chen Y, Shi C, et al. SOAPnuke : un logiciel compatible avec l'accélération MapReduce pour le contrôle qualité intégré et le prétraitement des données de séquençage à haut débit. GigaScience 7 (2018) : 1-6.
- Bo Li, Dewey CN. RSEM : quantification précise des transcrits à partir des données RNA-Seq avec ou sans génome de référence. BMC Bioinform 12 (2011): 323.
- Love MI, Huber W, Anders S. Estimation modérée du changement de pli et de la dispersion des données ARN-seq avec DESeq2. Génome Biol 15 (2014): 1-21.
- Langmead B, Salzberg SL. Alignement rapide de la lecture avec espacement avec Bowtie 2. Nat Methods 9 (2012): 357-359.
- Enright AJ, John B, Gaul U, et al. Cibles de microARN chez la drosophile. Génome Biol 5 (2003): R1.
- Agarwal V, Bell GW, Nam J, et al. Prédire les sites cibles de microARN efficaces dans les ARNm de mammifères. Elife 4 (2015) : e05005.
- Gendler SJ, Lancaster CA, Taylor-Papadimitriou J, et al. Clonage moléculaire et expression de mucine épithéliale polymorphe associée à une tumeur humaine. J Bio Chem 265 (1990): 15286-15293.
- Hollingsworth MA, Swanson BJ. Mucines dans le cancer : protection et contrôle de la surface cellulaire. Nat Rev Cancer 4 (2004): 45-60.
- Singh PK, Hollingsworth MA. Mucines associées à la surface cellulaire dans la transduction du signal. Tendances Cell Biol 16 (2006): 467-476.
- Man HY, Wang Q, Lu WY, et al. L'activation de la PI3-kinase est nécessaire pour l'insertion du récepteur AMPA pendant la LTP des mEPSC dans les neurones de l'hippocampe en culture. Neuron 38 (2003): 611-624.
- King D, Yeomanson D, Bryant HE. PI3King the lock : cibler la voie PI3K/Akt/mTOR comme nouvelle stratégie thérapeutique dans le neuroblastome. J Pediatr Hematol Oncol 4 (2015): 245-245.
- Peltier J, O'Neill A, Schaffer DV. PI3K/Akt et CREB régulent la prolifération et la différenciation des progéniteurs hippocampiques neuraux adultes. Dev Neurobiol 67 (2007): 1348-1361.
- Rafalski VA, Brunet A. Métabolisme énergétique dans le destin des cellules souches neurales adultes. Programme. Neurobiol 93 (2011): 182-203.
- Ojeda L, Gao J, Hooten KG, et al. Rôle critique de PI3K/Akt/GSK3β dans la spécification des motoneurones à partir de cellules souches neurales humaines en réponse au FGF2 et à l'EGF. PLOS UN 6 (2011): e23414.
- Wyatt LA, Filbin MT, Keirstead HS. L'inhibition de PTEN améliore la croissance des neurites dans les cellules progénitrices neuronales dérivées de cellules souches embryonnaires humaines. J Comp Neurol 522 (2014): 2741-255.
- Kanehisa M, Araki M, Goto S, Hattori M, et al. KEGG pour relier les génomes à la vie et à l'environnement. Nucleic Acids Res 36 (2008): 480-484.
- Zhu X. et al. Profilage comparatif de l'expression génique et développement du caractère de l'angine de poitrine instable. J Altern Complement Integr Med 7 (2021): 192.
- Ju Son D. Le microARN-712 mécanosensible atypique dérivé de l'ARN pré-ribosomique induit une inflammation endothéliale et l'athérosclérose. Nat Commun 4 (2013): 3000.
- Sloan KE, Warda AS, Sharma S, et al. Réglage du ribosome : L'influence de la modification de l'ARNr sur la biogenèse et la fonction du ribosome eucaryote. ARN Bio 14 (2017) : 1138-1152.
- Cao X, Li W, Wang T, et al. Vieillissement biologique accéléré chez les patients COVID-19. Nat Commun 13 (2022): 2135.
- Chan JC, Hannan KM, Riddell K, et al. AKT favorise la synthèse d'ARNr et coopère avec c-MYC pour stimuler la biogenèse des ribosomes dans le cancer". Sci Signal 4 (2011): ra56.
- Hoppe S, Bierhoff H, Cado I, et al. La protéine kinase activée par l'AMP adapte la synthèse d'ARNr à l'apport d'énergie cellulaire. Proc Natl Acad Sci USA 106 (2009): 17781-17786.
- Liang XH, Liu Q, Fournier MJ. La perte de modifications de l'ARNr dans le centre de décodage du ribosome altère la traduction et retarde fortement le traitement pré-ARNr. ARN 15 (2009) : 1716-1728.
- Brandman O, Hegde RS. Contrôle de la qualité des protéines associées aux ribosomes. Nat. Structure. Mol. Biol 23 (2016): 7-15.
- King D, Yeomanson D, Bryant HE. PI3King the lock : cibler la voie PI3K/Akt/mTOR comme nouvelle stratégie thérapeutique dans le neuroblastome. J Pediatr Hematol Oncol 37 (2015): 245-251.
- Rafalski VA, Brunet A. Métabolisme énergétique dans le destin des cellules souches neurales adultes. Programme. Neurobiol 93 (2011): 182-203.
- Man HY, Wang Q, Lu WY, et al. L'activation de la PI3-kinase est nécessaire pour l'insertion du récepteur AMPA pendant la LTP des mEPSC dans les neurones de l'hippocampe en culture. Neuron 38 (2003): 611-624.
- Wyatt LA, Filbin MT, Keirstead HS. L'inhibition de PTEN améliore la croissance des neurites dans les cellules progénitrices neuronales dérivées de cellules souches embryonnaires humaines. J Comp Neurol 522 (2014): 2741-255.
- Cohen, J. Le premier vaccin à ARNm auto-copiant fait ses preuves dans un essai pandémique. Sciences 376 (2022): 6592.
- Ivashchenko A, Pyrkova A, Akimniyazova A, et al. Les piARN sont un nouvel outil de lutte contre le COVID-19. Place de la Rés.
Fichiers supplémentairesTableau étendu supplémentaire 1 : SNP (panneau supérieur) et variantes de type épissure (panneau inférieur) au cours du temps. Les échantillons de patients : au cours du temps de l'administration Huaier ; 1. Avant l'administration Huaier ; 2. Un mois après l'administration Huaier; 3. 3 mois après l'administration Huaier.
Tableau étendu supplémentaire 2 : Comparaison des DEG liés à la production de cellules iPS (KIT, Myc, Oct 3/4, S0X2, Lin28A et NANOG). un. La boîte rouge représente les molécules régulées à la hausse et la boîte bleue représente les molécules régulées à la baisse. b. Les changements quantitatifs ont été indiqués par le calcul du changement de pli transformé en log 2 par les barres rouges (molécules régulées à la hausse) et les barres bleues (molécules régulées à la baisse).

Aucun commentaire:
Enregistrer un commentaire
Remarque : Seul un membre de ce blog est autorisé à enregistrer un commentaire.